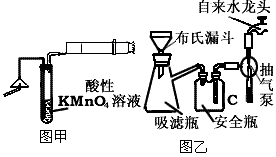
化学反应速率是指在单位时间内,反应物转化为生成物的程度。这个概念可以帮助我们了解化学反应进行的快慢和反应进行的程度。在实验中,我们通常需要测定化学反应的速率,以便更好地了解反应机制和反应动力学。
化学反应速率通常可以通过实验测定。在实验中,我们可以观察到反应物浓度的变化与时间的关系。随着反应的进行,反应物浓度会逐渐降低,而生成物的浓度会逐渐增加。因此,我们可以通过测量反应物和生成物浓度的变化来计算化学反应的速率。
化学反应速率通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。在实验中,我们可以使用不同的方法来测定反应物和生成物的浓度,例如分光光度法、电化学方法、色谱法等。这些方法可以根据不同物质的性质和反应类型进行选择。
化学反应速率与反应物的浓度、温度、压力、催化剂等条件有关。在实验中,我们可以控制这些条件来研究不同因素对化学反应速率的影响。例如,我们可以改变反应物的浓度、温度和压力来观察这些因素对反应速率的影响。我们还可以使用催化剂来加速化学反应的速率。
化学反应速率测定实验原理的应用非常广泛。例如,在化学工业中,我们可以通过测定化学反应的速率来优化生产过程,提高生产效率和产品质量。在环境保护中,我们可以通过测定化学反应的速率来了解污染物的降解速度和污染治理效果。在生物医学领域,我们可以通过测定化学反应的速率来研究生物体内的化学过程和药物代谢动力学。
化学反应速率测定实验原理是化学学科中的重要概念之一。通过了解化学反应速率的定义、测定方法和影响因素,我们可以更好地理解化学反应进行的机制和动力学过程。同时,掌握化学反应速率测定实验原理的应用也可以帮助我们在生产、科研和生活中更好地解决实际问题。